La Leucemia Mieloide Crónica (LMC) es un tipo de leucemia causado por una alteración genética. Una célula madre hematopoyética sufre una traslocación entre el cromosoma 9 y el 22 que afecta a los genes BCR y ABL y resulta la formación de un tránscrito BCR-ABL, conocido como cromosoma Filadelfia. Este nuevo gen produce una proteína BCR-ABL que, como el gen ABL, es una tirosina quinasa (TK).
Este tipo de leucemia representa aproximadamente el 15% de todas las leucemias y cada año se diagnostica un caso por cada 100.000 habitantes. Cada vez son más los pacientes que sobreviven a esta enfermedad y esto hace que la prevalencia, o proporción de individuos que presentan esta enfermedad, ha ido aumentando con los años de forma considerable debido a la gran eficacia de los nuevos tratamientos disponibles.
La Leucemia Mieloide Crónica es la neoplasia mejor estudiada y esta investigación es la que ha hecho posible que se llegue al diseño de fármacos inhibitorios de la enzima BCR-ABL, los inhibidores de tirosin quinasa (TKIs).
Índice de contenidos
¿Cómo actúan los TKIs en la Leucemia Mieloide Crónica?
Los TKIs interrumpen la cadena de señales proliferativas y antiapoptóticas, que la enzima BCR-ABL dispara en la célula. Al interrumpir esas señales, las células leucémicas y sus progenitoras mueren progresivamente.
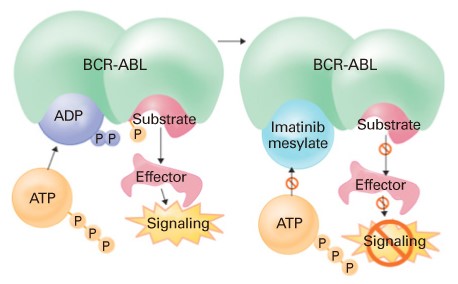
El resultado es que el clon leucémico va disminuyendo de tamaño y se van provocando las respuestas de interés:
- Respuesta Hematológica Completa (RHC). Hemograma normal y sin signos de Leucemia Mieloide Crónica.
- Respuesta Citogenética Completa (RCC). Todas las metafases del cariotipo medular son normales.
- Respuestas moleculares, basadas en el análisis de PCR cuantitativa en sangre. Si el ratio BCR-ABL/gen control ≤0.1% se llama respuesta molecular mayor (RMM) y si la respuesta es todavía más profunda 0.01 % (RM4), 0.032 % (RM4.5), 0.001 % (RM%) o 0 % (indetectable) se llama Respuesta Molecular Completa (RMC).
¿Qué ha cambiado en estos últimos 20 años?
El primero de estos inhibidores (TKIs) fue imatinib en 2001. Cuatro nuevos fármacos (nilotinib, dasatinib, bosutinib y ponatinib) han sido aprobados entre 2001 y 2013 y están disponibles actualmente en todo el mundo. El primer intento de establecer una política compartida internacionalmente de tratamiento con TKIs fue hecho por un panel de expertos pertenecientes a la red europea de leucemia, European Leukemia Net (ELN), en 2006 que posteriormente fue revisada en 2009 y 2013.
Después de 2013 ha habido otros estudios, como el estudio IRIS (International Randomized Study of Interferon). Un estudio multicéntrico de 1106 pacientes recién diagnosticados de 16 países diferentes comparando imatinib con Interferón-α durante 5 años de tratamiento. Los resultados del IRIS mostraron que imatinib era notablemente más eficaz y presentaba menos efectos secundarios que el interferón alfa combinado con citarabina.
Hay muchos otros estudios publicados que se han realizado posteriormente y se han ido actualizando comparando imatinib con la segunda generación de TKIs (2GTKIs), dasatinib, nilotinib y bosutinib.
Las recomendaciones de la ELN no han sido todavía actualizadas a fecha de hoy, pero la Sociedad Europea de Oncología Médica sí que actualizó sus recomendaciones en 2017. Las definiciones de “respuesta óptima” y “fracaso” (que sugieren no cambiar el tratamiento o cambio a otro TKI diferente, respectivamente) han variado, pero el principal objetivo de todas las recomendaciones hasta ahora era asegurar la mejor supervivencia.
Sin embargo, a día de hoy, la expectativa de doctores y pacientes ha cambiado y existe una tendencia a que el objetivo principal del tratamiento de Leucemia Mieloide Crónica (LMC) pase de la supervivencia a conseguir una discontinuación del tratamiento o remisión libre de tratamiento (TFR).
Según las recomendaciones de ELN 2013 tanto imatinib, nilotinib y dasatinib son recomendaciones de primera línea de tratamiento, aunque esta elección es todavía a día de hoy un tema de debate.
Un grupo italiano (GIMEMA CML WP, Italian Group for Hematologic Diseases of the Adult) publicó en diciembre de 2019 un estudio en el que tratan de llegar a un consenso reuniendo datos de 50 centros clínicos de toda Italia, tratando de seleccionar qué políticas de tratamiento podrían aumentar la probabilidad de discontinuación del mismo.
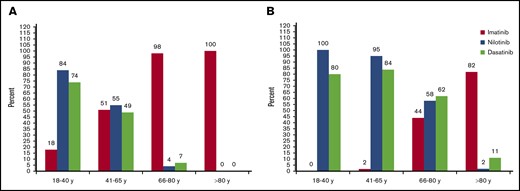
Analizando datos obtenidos de este estudio se resumen algunas sugerencias obtenidas que podrían ayudar a optimizar la estrategia de tratamiento:
- Porcentaje de pacientes de bajo riesgo.
- Porcentajes de pacientes de intermedio y alto riesgo.
Se obtuvo consenso para la elección de TKIs de segunda generación (nilotinib o dasatinib) en todos los pacientes jóvenes (18-40 años) y en pacientes adultos de intermedio y alto riesgo. También se obtuvo consenso para tratamiento con imatinib en pacientes mayores (66-80 años) de bajo riesgo y en todos los pacientes mayores de 80 años.
Por el contrario, no se obtuvo consenso para los pacientes adultos de bajo riesgo y mayores de riesgo intermedio y alto.
Muchos estudios algunos retrospectivos y otros prospectivos han demostrado que una proporción constante, entre el 30% y el 70% de los pacientes que interrumpen el tratamiento permanecen libres por un periodo de tiempo aún no definido.

El Grupo español de Leucemia Mieloide Crónica (GELMC) publicó en 2019 la experiencia española de discontinuación terapéutica en la práctica clínica habitual con un 64% de los pacientes permaneciendo libres de la enfermedad a los 4 años de la suspensión de TKI.
La posibilidad de alcanzar la TFR puede depender de varios factores: leucemia o características del paciente, tipo de TKI, duración del tratamiento, duración de la respuesta molecular completa, etc. Con estos y algunos otros criterios la suspensión de los TKIs es seguida de una probabilidad de TFR a los 5 años del 50%, lo cual nos debe llevar a pensar que la curación de la Leucemia Mieloide Crónica mediante el tratamiento por ITKs es posible.
Monitorización del tratamiento
Las altas tasas de discontinuación del tratamiento (TFR) obtenidas hasta el momento pueden derivarse de la prolongada exposición al tratamiento con TKI (mediana aprox. de 10 años) y la duración sostenida de respuesta molecular completa, RMC (mediana aprox. de 5 años) antes de la interrupción del tratamiento.
Estas dos variables son las que más afectan a la probabilidad de supervivencia libre de recaída molecular.
Todos los datos presentados en el último Congreso de la Sociedad Americana de Hematología (ASH 2019) sugieren que una monitorización molecular estricta y continua es muy importante después de suspender el tratamiento, incluso a largo plazo.
Necesitamos herramientas precisas y sensibles para evaluar la respuesta al interrumpir la terapia. Necesitamos una prueba totalmente fiable de PCR cuantitativa con una sensibilidad para detectar al menos respuesta molecular completa de 4.5 (MR4.5).
Nos surgen algunas preguntas:
- ¿Nos estamos tomando suficientemente en serio la estrecha monitorización por PCR en pacientes en remisión sin tratamiento?
- ¿Todos los clínicos tienen acceso a resultados de respuestas moleculares completas, RMC, informadas a Escala Internacional (IS)?
- ¿Se están utilizando correctamente las guías de práctica clínica más actualizadas para la interrupción de la terapia de TKIs?
Nuevas tecnologías para Leucemia Mieloide Crónica
Actualmente y después de mucho esfuerzo internacional, la expresión de BCR-ABL obtenida en cada laboratorio por PCR cuantitativa se estandariza y expresa como “escala internacional, IS”.
La PCR sigue siendo el “gold standard” para el estudio de la reducción de la carga de la enfermedad y permitir la monitorización precisa. Sin embargo, han surgido a lo largo de los últimos años otras tecnologías nuevas y también prometedoras:
- PCR digital, que parece ser una buena herramienta, sensible y precisa para la monitorización. Sin embargo, es necesaria una estandarización internacional antes de que esta técnica entre en métodos rutinarios.
- Secuenciación de próxima generación, NGS, que se usa con frecuencia para detectar mutaciones en el dominio quinasa de ABL, que son mecanismos de resistencia de Leucemia Mieloide Crónica al tratamiento.
Es una tecnología mucho más compleja que la PCR y todavía se desconoce si la secuenciación profunda puede competir con la sensibilidad obtenida por métodos cuantitativos como la PCR cuantitativa o la PCR digital.
Retos actuales
- 1. Los científicos están dirigidos a buscar nuevos tratamientos (monoterapia o combinación) lo menos tóxicos posible, ya que “los efectos adversos de los TKIs constituyen una importante preocupación tanto para los pacientes que los sufren como para los hematólogos dedicados a la LMC”, afirma el Dr. Steegman, presidente del Grupo Español de Leucemia Mieloide Crónica (GELMC).
- Algunos de estos nuevos fármacos (de 4ª generación) podrían ser: Asciminib, que inhibe la molécula BCR-ABL en lugar diferente al resto de inhibidores, o también el PF-114 que podría ser un potente inductor de apoptosis en células LMC. Ambos todavía están en fase de estudios clínicos.
- 2. Los datos de interrupción de terapia en niños con Leucemia Mieloide Crónica son limitados. Una preocupación importante en el tratamiento de pacientes pediátricos es precisamente la seguridad ante la administración prolongada. La biología de la leucemia en niños puede diferir de la de los adultos con una presentación más agresiva y la interrupción del tratamiento es controvertida.
- 3. Por supuesto, otro de los retos es incrementar los porcentajes de pacientes libres de enfermedad tras la suspensión del tratamiento.
Está claro que la base del éxito con los pacientes de Leucemia Mieloide Crónica siempre será la colaboración estricta entre investigadores, técnicos y clínicos.
Esto nos permitirá avanzar hacia la práctica clínica y seguir con esta revolución, ya que la industria farmacéutica está dedicada a avanzar en este campo con terapias cada vez más eficaces y menos tóxicas, con lo que eso supone para la calidad de vida del paciente.
Artículos relacionados
Cáncer de colon. El cáncer más fácil de prevenir
Los virus aliados contra el cáncer
El mejor amigo del hombre: los perros podrían detectar el cáncer con precisión