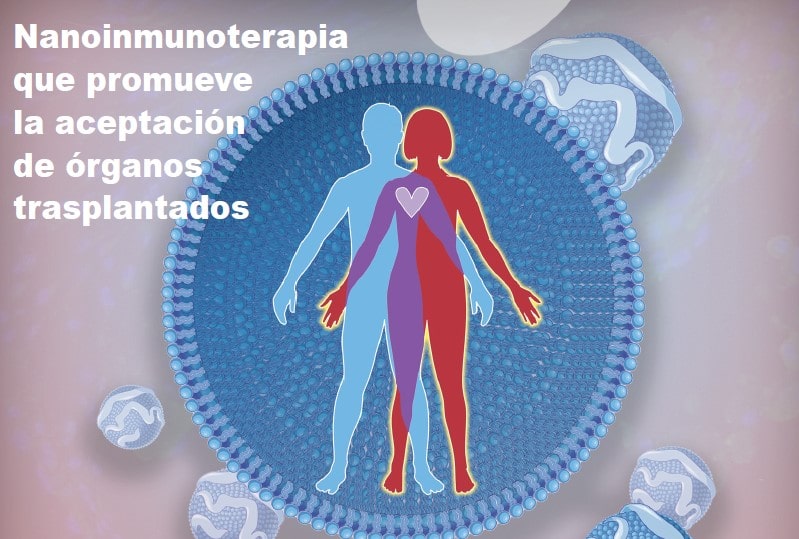
Un reciente estudio preclínico demuestra que una nanoinmunoterapia que actúa modulando la inmunidad entrenada en macrófagos es capaz de promover la tolerancia de los órganos trasplantados.
Aproximadamente el 50% de los órganos sólidos trasplantados no sobrevive más allá de 10 años. Los pacientes trasplantados requieren terapia inmunosupresora de por vida, con fármacos que son inespecíficos y que se acompañan de importantes efectos secundarios, incluyendo toxicidad metabólica, infección y cáncer.
El tratamiento actual, orientado a bloquear la activación de la inmunidad adaptativa (linfocito T principalmente), no logra detener la respuesta inmune frente al trasplante y los injertos acaban fracasando en periodos de tiempo muy inferiores a los que les correspondería de acuerdo a la edad original del órgano. Los resultados actuales en trasplante de órganos son subóptimos y la aceptación definitiva de los injertos por el receptor es un objetivo todavía no alcanzado.
Un consorcio de 7 grupos de investigación ha puesto en marcha el proyecto NIETO-CM (Nanoterapia dirigida a Inmunidad Entrenada para la Aceptación de Trasplante de Órganos) financiado por la Comunidad de Madrid. El proyecto – figura 1 – se basa en los resultados del estudio preclínico publicados en la revista Immunity por el investigador principal del consorcio, el Dr. Jordi Ochando.
Esta publicación describe una nanoinmunoterapia que combina nanopartículas de lipoproteínas de alta densidad con rapamicina (mTORi-HDL) que, tras una breve administración en animales trasplantados, previene la respuesta inmunológica y promueve la tolerancia al injerto.
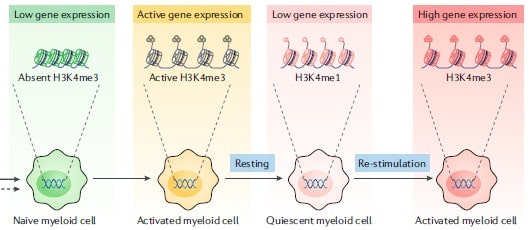
La nanoinmunoterapia mTORi-HDL actúa bloqueando específicamente una forma de activación de los macrófagos denominada inmunidad entrenada. Este término define una forma de “memoria” de la inmunidad innata consistente en que los macrófagos, una vez expuestos a determinados ligandos de agentes infecciosos, experimentan cambios epigenéticos y metabólicos que sólo se revierten parcialmente, lo cual les permite generar respuestas protectoras posteriores más potentes y eficaces frente a nuevas infecciones – figura 2 -.
La inmunidad entrenada explica observaciones epidemiológicas clásicas, como, por ejemplo, que la vacuna BCG, una de las más administradas en el mundo, además de conferir protección frente a Mycobacterium tuberculosis también proteja frente a enfermedades como lepra, fiebre felina o candidiasis sistémica diseminada, e incluso frente a tumores malignos como melanoma, cáncer de vejiga, leucemia y linfoma.
Fuera del ámbito de la inmunidad anti-infecciosa y en particular en la inmunología del trasplante de órganos, la publicación del Dr. Ochando demuestra por primera vez, en un modelo animal, que la “inmunidad entrenada” es un obstáculo para la aceptación y tolerancia del trasplante y que se puede prevenir mediante la nanoinmunoterapia mTORi-HDL para mejorar la supervivencia y funcionalidad del injerto.
El consorcio NIETO-CM tiene por objetivos demostrar el mecanismo de inmunidad entrenada en el trasplante clínico y su relación con el daño isquemia-reperfusión, la sensibilización anti-HLA o infecciones frecuentes en el paciente trasplantado, como las causadas por Citomegalovirus o Cándida.
Este proyecto marcadamente traslacional puede mejorar sustancialmente el futuro de los pacientes trasplantados y reviste enorme interés, además, para nuestro Sistema de Salud, por su liderazgo en Trasplante de Órganos. Los datos que se obtengan pueden sentar las bases para un próximo ensayo clínico fase I de la nanoinmunoterapia en humanos.
Autora: Dra. Estela Paz Artal
Jefa del Servicio de Inmunología en el Hospital 12 de Octubre de Madrid
Profesora de Inmunología en la Universidad CEU San Pablo