Índice de contenidos
Principios básicos de inmunoterapia
El uso del sistema inmune como herramienta para luchar contra el cáncer no es una idea del todo novedosa (Hoos et al., 2012; Adams et al., 2015).
En 1891, el cirujano William Coley fue el primero en realizar esta aproximación inyectando bacterias directamente en un carcinoma de hueso inoperable. En ese momento, no se había desarrollado ni la quimioterapia ni la radioterapia y había muy pocas opciones.
Esta forma de inmunoterapia sería utilizada posteriormente por Coley y otros clínicos, usando bacterias y productos de bacterias a los que llamaron toxinas de Coley para el tratamiento de tumores agresivos Y que, posiblemente, generaban una respuesta inmune anti-tumoral debido a la presencia de productos bacterianos inmunomoduladores.
El objetivo principal de la inmunoterapia es estimular las defensas naturales del organismo para eliminar las células malignas, lo que ha revolucionado el tratamiento frente al cáncer.
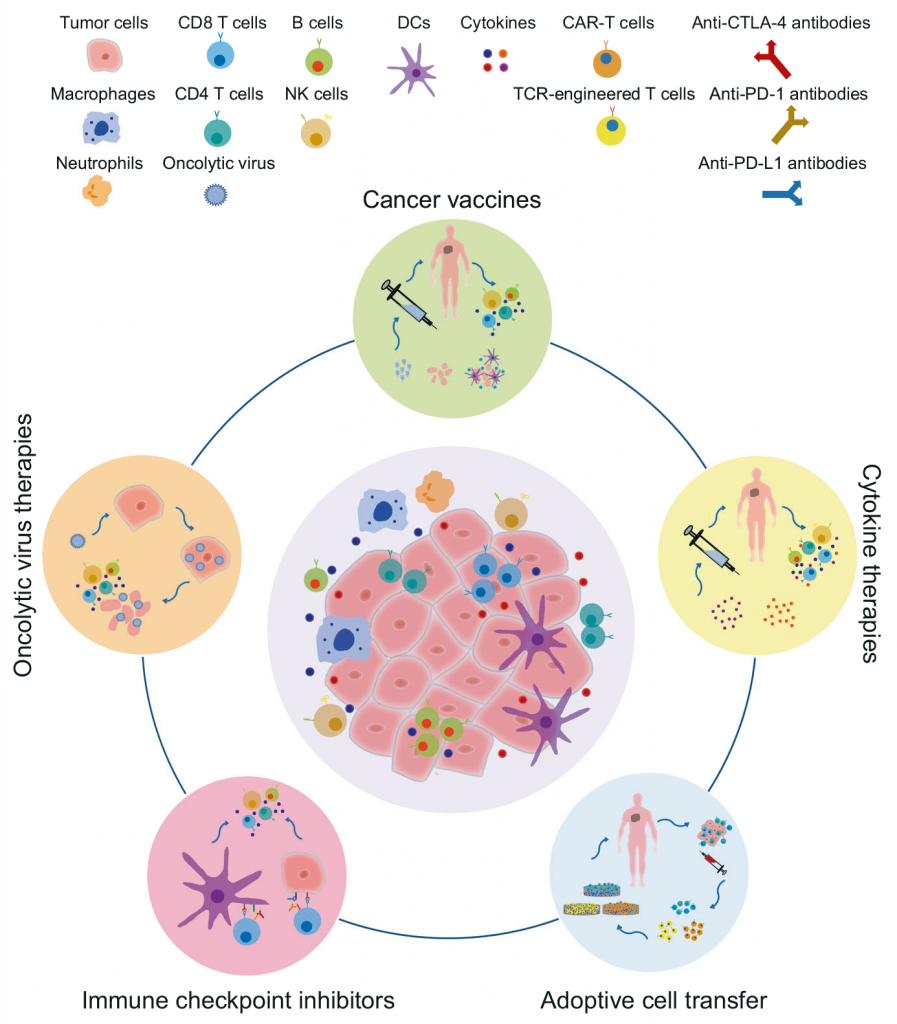
Existen varios tipos de inmunoterapia como la transferencia de células adoptivas, vacunas, citoquinas y los inhibidores de los puntos de control, aunque la eficacia de una u otra varía y, únicamente, algunos pacientes con distintos tipos de cáncer se benefician de ella.
Los infiltrados linfocitarios juegan un papel importante en el microambiente tumoral y en el pronóstico de los pacientes. Estas células son fundamentales en el desarrollo de mecanismos de evasión tumorales, aportando también oportunidades para el desarrollo de estrategias terapéuticas (Zhang et al., 2020).
Inmunoterapia de puntos de control
Dentro de la inmunoterapia activa de la inmunología, que pretende estimular el sistema inmune del propio paciente frente al tumor para así reactivarlo y modularlo, se encuentra la inmunoterapia activa específica que utiliza anticuerpos monoclonales frente a antígenos tumorales de cada paciente o frente a puntos de control. Dichos anticuerpos pueden usarse, sin modificar o conjugados, a otros agentes como toxinas, quimioterápicos o partículas radioactivas que incrementen sus efectos anti-tumorales, disminuyendo su toxicidad.
Hay dos estrategias fundamentales en inmunoterapia de puntos de control: por un lado, se bloquean los puntos de control inhibidores como PD-1 (Programmed Death 1) y CTLA-4 (Cytotoxic T-Lymphocyte-Associated protein 4 también llamado CD152) y una segunda estrategia es activar los puntos de control activadores como CD28 o CD40L.
El receptor PD-1, tiene dos ligandos, PD-L1 y PD-L2. Este punto de control es la diana de algunos fármacos que ya están en el mercado. La ventaja de utilizar PD-1 como diana es que puede restablecer la función inmune en el microambiente tumoral.
Otro punto de control es CTLA-4, diana de otros fármacos también con aprobación de la FDA desde hace unos 10 años aproximadamente. En concreto, la expresión de CTLA-4 en linfocitos T reguladores sirve de control para la proliferación de los linfocitos T.
Los ejemplos de estos anticuerpos son Nivolumab frente a PD-1 en melanoma, cáncer de pulmón, riñón o vejiga o Ipilimumab, que se usa en melanoma frente CTLA-4. Ambos son de origen humano, reduciendo la respuesta inmune frente a los mismos.
Ruta PD-1/PD-L1 y receptor CTLA-4
La unión del ligando PD-L1 con sus receptores PD-1 o B7.1 (CD80) transmite una señal inhibitoria a los linfocitos T, que reduce su proliferación y puede causar su apoptosis como consecuencia de una inhibición del gen Bcl-2.
A su vez, PD-L1 transmite señales intracelulares en las células que favorecen la proliferación y supervivencia celular, y protegen frente a estímulos pro-apoptóticos como los interferones.
El ligando PD-L1 se une a su receptor PD-1, que se encuentra expresado tanto en la superficie de linfocitos T y B activados, como en otras células de linaje mieloide. Esta unión ligando-receptor modula la activación y las funciones de éstas células. Asimismo, PD-L1 presenta también una afinidad significativa por la molécula co-estimuladora CD80 (B7-1), pero no por CD86 (B7-2).
La unión de PD-L1 con su receptor PD-1 expresado en los linfocitos T genera una señal en éstos que inhibe la producción de interleucina 2 (IL-2) dependiente del receptor del linfocito T (TCR) y su proliferación. Estos efectos son causados por la inhibición de la fosforilación de ZAP-70 y su asociación con la cadena zeta del TCR CD3ζ
La señalización de PD-1 producida por la unión con PD-L1 atenúa también la fosforilación de PKC-θ, necesaria para la activación de los factores de transcripción NF-κB y AP-1, y la producción IL-2 como resultado del reconocimiento de antígeno por parte del TCR del linfocito T.
La unión de PD-L1 también induce la expresión de la ubiquitina ligasa E3 CBL-b, causando la internalización del TCR.
A su vez, PD-L1 tiene capacidad de señalizar intracelularmente en las células tumorales, protegiéndolas frente a estímulos pro-apoptóticos como la unión Fas-FasL o los interferones. Esta señalización intrínseca de PD-L1 activa la ruta metabólica mTOR, favoreciendo la supervivencia y crecimiento celular.
El incremento de la expresión de PD-L1 es uno de los mecanismos que permiten al tumor escapar del ataque del sistema inmunitario. Es un mecanismo de resistencia inmune adaptativa en respuesta a la actividad anti-tumoral endógena.
En algunos tipos de cáncer como el carcinoma renal, los niveles de expresión de PD-L1 correlacionan con la agresividad del mismo. Todavía se están desarrollando inhibidores de PD-L1 para aplicarlos como inmunoterapia contra el cáncer. Estos inhibidores, en su mayoría anticuerpos monoclonales específicos frente a PD-L1, están mostrando resultados significativos en ensayos clínicos y como terapias clínicas de primera línea (en cánceres que no han sido tratados previamente) y como terapias de segunda línea de tratamiento (en cánceres ya tratados con otras terapias). Los anticuerpos Atezolizumab y Avelumab son dos ejemplos utilizados actualmente en clínica.
En definitiva, la unión de PD-L1 a PD-1 impide que los linfocitos T destruyan las células tumorales. Sin embargo, el bloqueo de la unión de PD-L1 con PD-1 mediante un inhibidor de puntos de control inmunitario (anti-PD-L1 o anti-PD-1) permite que los linfocitos T destruyan las células tumorales.
Por otro lado, CTLA-4 es un receptor proteico situado en la membrana de los linfocitos T, siendo la principal molécula inhibidora, y su estimulación disminuye la actividad de los linfocitos T, disminuyendo su función, frenando su proceso de proliferación y provocando su muerte.
CTLA-4 compite con CD28 por su unión a CD80/CD86 e inhibe la señalización. El uso de anticuerpos como Ipilumumab frente a CTLA-4 libera CD80/CD86, favoreciendo su unión a CD28 y por tanto, la proliferación de linfocitos T CD8+.
La naturaleza de los antígenos tumorales, la migración de células del sistema inmune al tumor y la expresión de los receptores y ligandos de puntos de control son posibles biomarcadores. Los linfocitos T citotóxicos CD8+ son los más afectados por la ruta PD-1/PD-L1. Mientras que CTLA-4 regula fundamentalmente la actividad de los linfocitos CD4+, efectores y reguladores.
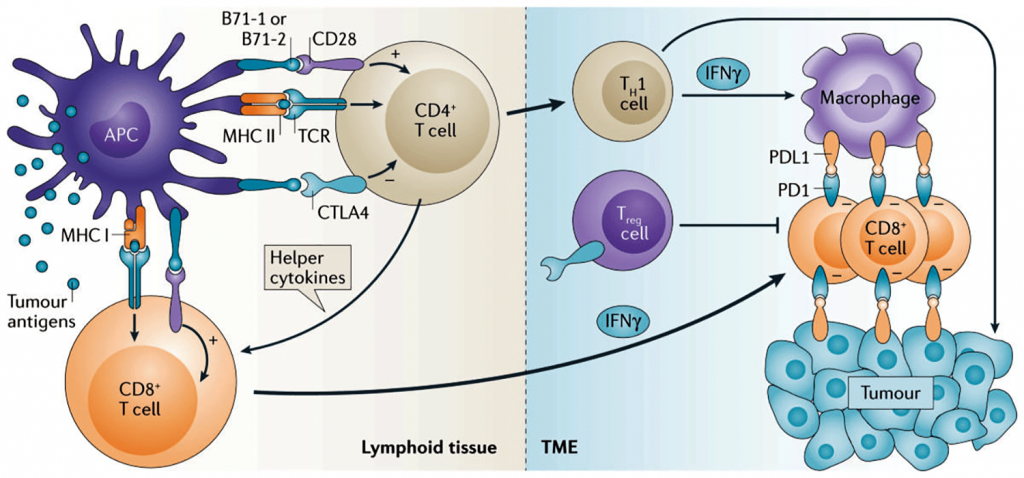
La activación de los linfocitos T requiere el reconocimiento de antígenos tumorales presentados por células presentadoras de antígenos como monocitos y células dendríticas a través de su receptor TCR que se une al complejo mayor de histocompatibilidad y a péptidos derivados de los antígenos tumorales.
Estos antígenos pueden generarse a partir de proteínas asociadas del tumor con o sin mutaciones. La activación de las células T ocurre generalmente en tejido linfoide y los linfocitos T CD4+ participan en la activación de los CD8+ mediante la liberación de diversas citoquinas.
Ambos tipos de linfocitos son activados a través de moléculas de co-estimulación como CD28 B7-1 (CD80) y CD28 B7-2 (CD86), causando su proliferación, liberación de citoquinas inflamatorias, adquisición de propiedades citolíticas y la migración al sitio del tumor.
CTLA-4 tiene un papel muy importante en este sentido. Durante horas e incluso días, los linfocitos T activados comienzan a expresar el receptor PD1. Los linfocitos colaboradores CD4+ (TH1) y los CD8+ en el microambiente tumoral producen interferón-γ (IFNγ). El cual, por un lado activa a macrófagos para atacar al tumor y, por otro, induce la expresión del ligando PD-L1 tanto por macrófagos como por células tumorales. Las células T CD8+ PD1+ específicas frente al tumor encuentran células PD-L1+ en el microambiente tumoral.
Además, la expresión de CTLA-4 por linfocitos Treg en el microambiente tumoral incrementa su habilidad para suprimir la producción de citoquinas dependiente de linfocitos T CD8+ y favorecer la muerte de células tumorales. Fármacos que bloqueen estos puntos de control pueden interrumpir interacciones de inmunosupresión y favorecer la habilidad de los linfocitos T para eliminar células cancerosas que expresen determinados antígenos (Figura 2).
Relación de HLA-A*03 con inmunoterapia de puntos de control
Hoy en día, miles de personas toman inhibidores de puntos de control como tratamiento anti-tumoral. Aunque, en muchos casos, no son eficaces y se desconocen las razones exactas.
Disponer de biomarcadores predictivos en el campo de la inmunología de HLA podría resultar interesante. Ya que permitiría ser más precisos a la hora de su administración y eficacia. La inmunidad no es sencilla y, en este sentido, existen varios factores que funcionan en conjunto. Las moléculas HLA cumplen un papel fundamental junto con la carga mutacional del tumor y la microbiota intestinal.
Estudio del efecto de HLA-A*03 como biomarcador predictivo
Recientemente el grupo de la Dra. Carrington llevó a cabo un estudio en el que se evaluó el efecto de HLA-A*03 como biomarcador predictivo de la respuesta a inmunoterapia con inhibidores de puntos de control para el tratamiento de cánceres avanzados.
En este estudio epidemiológico se investigaron los resultados clínicos en relación a la supervivencia y a la tasa de respuesta tras el tratamiento de cánceres avanzados en 8 grupos de pacientes. En total, se trataron 3.335 pacientes con agentes inhibidores de punto de control (anti-PD-1, anti-PD-L1 y CTLA-4) y 10.917 pacientes se trataron con otras terapias.
La conclusión principal de este estudio está relacionada con HLA-A*03. En concreto, parece que la presencia de HLA-A*03 está asociada con una reducción de la supervivencia total tras el tratamiento con agentes inhibidores de punto de control en distintos tipos de tumores.
Así, los pacientes con HLA-A*03 tuvieron una supervivencia libre de enfermedad más corta en aquellos casos con carcinoma renal que recibieron Nivolumab.
Asimismo, también observaron un efecto de dosis dado que las personas con A*03 en homocigosis morían antes que las personas con una sola copia del alelo A*03 (2,3 veces más rápido) y estas últimas más rápido que las personas sin copias del alelo A*03.
La relación entre el alelo A*03 y la eficacia de los inhibidores de puntos de control inmunitario se comprobó sin importar la edad, el sexo o la ascendencia de la persona, el tipo de inhibidor de puntos de control inmunitario que tomó, y si recibió o no quimioterapia al mismo tiempo. Pero, no se estableció una relación entre el alelo y los desenlaces clínicos de otros tipos de tratamiento del cáncer.
La interpretación más probable es que HLA-A*03 podría ser un biomarcador predictivo de baja respuesta a terapias con inhibidores de punto de control, es decir, las personas con el alelo A*03 se beneficiarían menos de la inmunoterapia con inhibidores de puntos de control.
Sin embargo, serán necesarios más estudios randomizados para confirmar estos resultados y favorecer su uso como biomarcador de pronóstico (junto con otros biomarcadores) para el uso de una u otra terapia anti-tumoral (Carrington et al., 2022). Si otros estudios confirmasen esos resultados, se facilitaría la decisión en la administración de inhibidores de puntos de control, evitándose así los efectos secundarios derivados de su uso de forma inadecuada.
Bibliografía
Yuanyuan Zhang and Zemin Zhang. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cellular & Molecular Immunology 17:807–821 (2020).
Adams, J. L., Smothers, J., Srinivasan, R. & Hoos, A. Big opportunities for small molecules in immuno-oncology. Nat. Rev. Drug Discov. 14, 603–622 (2015).
Hoos, A. & Britten, C. The immuno-oncology framework: enabling a new era of cancer therapy. Oncoimmunology 1, 334–339 (2012).
Topalian SL, Taube JM, Anders RA, Pardoll DM. Mechanism-driven biomarkers to guide immune checkpoint blockade in cancer therapy. Nat Rev Cancer. 16(5):275-87 (2016).
Vivek Naranbhai , Mathias Viard, Michael Dean, Stefan Groha, David A Braun, Chris Labaki, Sachet A Shukla, Yuko Yuki, Parantu Shah, Kevin Chin, Megan Wind-Rotolo, Xinmeng Jasmine Mu, Paul B Robbins, Alexander Gusev, Toni K Choueiri, James L Gulley, Mary Carrington. HLA-A*03 and response to immune checkpoint blockade in cancer: an epidemiological biomarker study. Lancet Oncol (1):172-184 (2022).