Índice de contenidos
Células madre adultas
Las células madre tienen potencial para dar lugar a muchos tipos celulares distintos. Actúan como una especie de sistema de reparación pudiendo dividirse teóricamente, de manera ilimitada, durante la vida del individuo o del animal. Tienen dos características fundamentales que las distinguen de otros tipos celulares. En primer lugar, son células no especializadas capaces de auto-renovarse durante largos períodos de tiempo mediante división celular. En segundo lugar, bajo condiciones específicas, pueden ser inducidas para convertirse en células especializadas con funciones biológicas únicas, además de poder implantarse tanto en tejidos dañados como en tejidos sanos.
Clásicamente, las células madre adultas se han definido como células cuya capacidad de proliferación y diferenciación está más limitada que la de las células madre embrionarias. Hoy en día, las células madre han sido aisladas de una gran variedad de tejidos y órganos, incluyendo sangre periférica, médula ósea, músculo, tejido adiposo, páncreas, piel y sistema nervioso central. Las primeras que fueron identificadas pertenecían al linaje hematopoyético y fueron derivadas de hemocitoblastos de la médula ósea, pudiendo dar lugar a todos los tipos celulares sanguíneos, incluyendo el linaje mieloide y linfoide.C
Células mesenquimales
Durante los últimos años, las células mesenquimales (MSCs) y sus posibles aplicaciones biomédicas han recibido gran atención por parte de la comunidad científica (Ding et al., 2014). Las células mesenquimales fueron aisladas en primer lugar y de forma satisfactoria a partir de médula ósea (Friedenstein et al., 1966), demostrando que la médula ósea no sólo contiene células madre hematopoyéticas, sino que, también, contiene un tipo de células progenitoras multipotentes, con morfología fibroblástica. Después se han aislado de distintas fuentes como cordón umbilical, membrana sinovial, sangre periférica o tejido adiposo (Marofi et al., 2019; Ahani-Nahayati et al., 2018). La International Society for Cellular Therapy (ISCT) sugirió un criterio mínimo para identificar y caracterizar estas células por su adherencia al plástico, la expresión de determinados marcadores de superficie CD73, D90, CD105, la ausencia de expresión de CD14, CD34, CD45 y HLA-DR (Baghaei et al., 2017) y su capacidad para diferenciar in vitro a múltiples linajes celulares como adipocitos, condrocitos y osteocitos en función de las condiciones de cultivo (Hu et al., 2018). Además, estas células tienen otras propiedades como son la capacidad de auto-renovación, multipotencialidad, fácil obtención y su gran secretoma compuesto por cientos de mediadores como citoquinas y moléculas de señalización, que pueden modular de forma efectiva la respuesta inflamatoria y controlar el proceso de infiltración que lleva a la regulación en la reparación y regeneración de los tejidos (Lim et al., 2017).
La inmunomodulación mediada por células mesenquimales es el resultado directo de una sinergia armoniosa de moléculas de señalización liberadas por estas células (mediadores, citoquinas, quemoquinas), la reacción de células inmunes y otras células diana de estas moléculas. Todas estas características las convierten en buenas candidatas terapéuticas en enfermedades mediadas por el sistema inmune como la enfermedad de injerto contra huésped (GVHD), esclerosis múltiple (MS), enfermedad de Crohn (CD), artrosis (OA), e incluso enfermedades infecciosas como la COVID-19 (Volarevic et al., 2017; Marofi et al., 2019).
Uso de células mesenquimales en la enfermedad de injerto frente a huésped
La enfermedad de injerto frente a huésped es una complicación severa detectada aproximadamente en el 40–60% de los trasplantes de células hematopoyéticas (HSC) y de forma menos frecuente en los trasplantes de órgano sólido. En el caso de GVHD aguda es una enfermedad inflamatoria en la que influyen varios factores como el reclutamiento de células inmune del donante y la liberación de citoquinas.
La terapia con células mesenquimales se presenta como una alternativa prometedora para el tratamiento de esta enfermedad (Fig. 1) (Fujii et al., 2018).
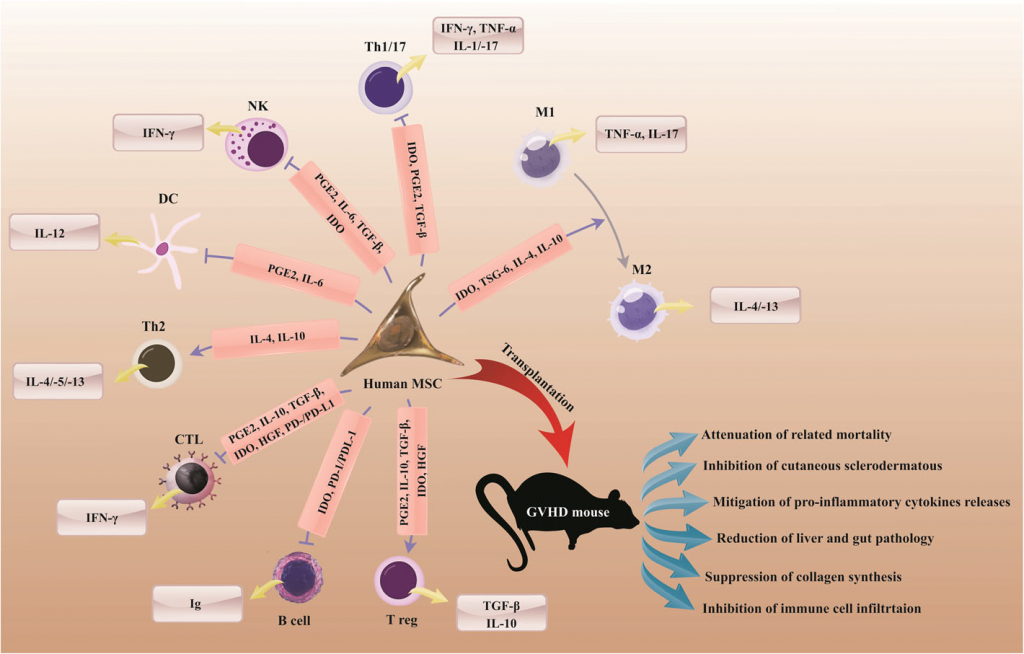
Figura 1. Terapia con células MSC para el tratamiento de GVHD. Debido a sus propiedades inmunomoduladoras, el uso de células MSC in vivo puede restaurar los síntomas clínicos que se dan en la enfermedad de injerto contra huésped (Markov et al., 2021).
Los mecanismos subyacentes que contribuyen a la inmunodulación de las células MSC no se han elucidado por complete en la actualidad, pero parece que el contacto célula-célula en combinación con factores tróficos, desde citoquinas a factores de crecimiento, puede jugar un papel relevante en este proceso. Además, estudios en modelos animales, así como varios ensayos clínicos han demostrado la seguridad y eficacia de la administración de MSCs y su secretoma para el tratamiento de enfermedades inmunológicas. Sin embargo, todavía se requieren más estudios que garanticen resultados clínicos óptimos. Asimismo, el potencial oncogénico que podría producirse por una diferenciación de estas células de manera descontrolada necesita ser investigado en profundidad, del mismo modo que se requieren estudios a gran escala para aumentar el conocimiento sobre su capacidad de migración y homing tras el trasplante.
La identificación del secretoma MSC como una alternativa libre de células con efectos terapéuticos puede suponer un nuevo paradigma para su aplicación en medicina regenerativa (Marolt et al., 2019). Los exosomas mantienen los beneficios terapéuticos de sus células originarias y evitan las posibles desventajas asociadas a una posible tumorogénesis o mutaciones indeseadas (Doyle et al., 2019). Estos exosomas podrían ser, incluso, modificados genéticamente para expresar determinados ligandos que los dirijan a tejidos diana, transfiriendo genes y otras moléculas directamente en el área de interés.
Trasplante de células hematopoyéticas alogénicas
El trasplante alogénico de células madre hematopoyéticas es fundamental para el tratamiento de enfermedades hematológicas graves. Sin embargo, sus resultados necesitan mejorar y la co-infusión de células mesenquimales puede resultar una estrategia prometedora que está siendo ampliamente estudiada, aunque con resultados no concluyentes por el momento en los distintos ensayos clínicos que se están llevando a cabo.
En concreto, en un reciente estudio que analizó diferentes ensayos se observó que la co-infusión de MSCs reduce el tiempo de implantación de neutrófilos y plaquetas, disminuye el riesgo de enfermedad crónica de injerto contra huésped y muestra una cierta tendencia en la reducción del riesgo de GVHD aguda, sin afectar a la supervivencia global y la recidiva.
Si se analiza el subgrupo de población infantil y adolescentes que se co-trasplantan con MSCs y HSCs HLA no idénticas se muestran mejoras en la implantación y una disminución en la incidencia de GVHD comparado con otros pacientes adultos con malignidades hematológicas a los que se les practicó un trasplante de HSCs HLA idéntico (Li et al., 2021)
Durante las últimas décadas el trasplante de células madre hematopoyéticas alogénicas (allo-HSCT) se ha convertido en una estrategia para salvar la vida de pacientes con enfermedades hematológicas malignas y no malignas (Copelan et al., 2019).
Clásicamente, antes de la inyección de HSCs, los receptores son sometidos a radioterapia o quimioterapia según las condiciones generales del paciente, el tipo de enfermedad, su estado y las opciones de donante, para eliminar las células malignas y suprimir el sistema inmune (Copelan et al., 2019). La implantación exitosa de células madre del donante limita los efectos terapéuticos de las HSCs. Sin embargo, varias complicaciones graves pueden restringir el éxito del trasplante como GVHD ya sea de forma aguda o crónica, recidivas o infecciones bacterianas, víricas o fungícas. Todos estos factores pueden causar una significativa morbilidad y mortalidad en los receptores de células hematopoyéticas alogénicas.
Es por esta razón por la que las células mesenquimales podrían mejorar los resultados de este tipo de trasplante mediante la inducción de un quimerismo mixto, tratamiento o profilaxis de GVHD, aceleración de la implantación de células hematopoyéticas y la inducción del efecto injerto contra leucemia (GVL) (Kim et al., 2013; Diehl et al., 2017). Se han llevado a cabo varios ensayos clínicos en este sentido, pero se requieren más estudios necesarios para evitar la heterogeneidad en las dosis y las distintas fuentes de MSCs utilizadas, que permitan la mejor solución para cada paciente (Le Blanc et al., 2007; Lee et al., 2013; Bernardo et al., 2011; Ball et al., 2007; Yue et al., 2018).
Bibliografía
- Ding D-C, Shyu W-C, Lin S-Z. Mesenchymal stem cells. Cell Transplant. 2011; 20:5–14.
- Friedenstein A, Piatetzky-Shapiro I, Petrakova K. Osteogenesis in transplants of bone marrow cells. Development. 1966; 16:381–90.
- Marofi F, Vahedi G, Hasanzadeh A, Salarinasab S, Arzhanga P, Khademi B, Farshdousti Hagh M. Mesenchymal stem cells as the game-changing tools in the treatment of various organs disorders: mirage or reality? J Cell Physiol. 2019; 234:1268–88.
- Ahani-Nahayati M, Solali S, Shams Asenjan K, Movassaghpour Akbari AA, Talebi M, Zadi Heydarabad M, Baharaghdam S, Farshdousti Hagh M. Promoter methylation status of survival-related genes in MOLT- 4 cells cocultured with bone marrow mesenchymal stem cells under hypoxic conditions. Cell J. 2018; 20:188–94.
- Baghaei K, Hashemi SM, Tokhanbigli S, Asadi Rad A, Assadzadeh-Aghdaei H, Sharifian A, Zali MR. Isolation, differentiation, and characterization of mesenchymal stem cells from human bone marrow. Gastroenterol Hepatol Bed Bench. 2017; 10:208–13.
- Hu MS, Borrelli MR, Lorenz HP, Longaker MT, Wan DC. Mesenchymal stromal cells and cutaneous wound healing: a comprehensive review of the background, role, and therapeutic potential. Stem Cells Int. 2018;2018: 6901983.
- Lim JY, Ryu DB, Lee SE, Park G, Min CK. Mesenchymal stem cells (MSCs) attenuate cutaneous sclerodermatous graft-versus-host disease (Scl-GVHD) through inhibition of immune cell infiltration in a mouse model. J Invest Dermatol. 2017; 137:1895–904.
- Volarevic V, Gazdic M, Markovic BS, Jovicic N, Djonov V, Arsenijevic N. Mesenchymal stem cell-derived factors: immuno-modulatory effects and therapeutic potential. Biofactors (Oxford, England). 2017; 43:633–44.
- Marofi F, Hassanzadeh A, Solali S, Vahedi G, Mousavi Ardehaie R, Salarinasab S, Aliparasti MR, Ghaebi M, Farshdousti Hagh M. Epigenetic mechanisms are behind the regulation of the key genes associated with the osteoblastic differentiation of the mesenchymal stem cells: the role of zoledronic acid on tuning the epigenetic changes. J Cell Physiol. 2019; 234:15108–22.
- Fujii S, Miura Y, Fujishiro A, Shindo T, Shimazu Y, Hirai H, Tahara H, Takaori-Kondo A, Ichinohe T, Maekawa T. Graft-versus-host disease amelioration by human bone marrow mesenchymal stromal/stem cell-derived extracellular vesicles is associated with peripheral preservation of naive T cell populations. Stem Cells. 2018; 36:434–45.
- Markov A, Thangavelu L, Aravindhan s, Olegovna Zekiy A, Jarahian M, Chartrand MS, Pathak Y, Marofi F, Shamlou s, Hassanzadeh A. Mesenchymal stem/stromal cells as a valuable source for the treatment of immune-mediated disorders. Stem Cell Research & Therapy (2021) 12:192
- Marolt Presen D, Traweger A, Gimona M, Redl H. Mesenchymal stromal/ stem cell-based bone regeneration therapies: from cell transplantation and tissue engineering to therapeutic secretomes and extracellular vesicles. Front Bioeng Biotechnol. 2019; 7:352.
- Doyle LM, Wang MZ. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells. 2019:8;8.
- Li T, Luo C, Zhang J, Wei L, Sun w, Xie Q, Liu Y, Zhao Y, Xu s, Wang L. Efficacy and safety of mesenchymal stem cells co-infusion in allogeneic hematopoietic stem cell transplantation: a systematic review and meta-analysis. Stem Cell Research & Therapy (2021) 12:246
- Copelan EA, Chojecki A, Lazarus HM, Avalos BR. Allogeneic hematopoietic cell transplantation; the current renaissance. Blood Rev. 2019; 34:34–44
- Kim EJ, Kim N, Cho SG. The potential use of mesenchymal stem cells in hematopoietic stem cell transplantation. Exp Mol Med. 2013;45(1):e2
- Diehl R, Ferrara F, Müller C, Dreyer AY, McLeod DD, Fricke S, et al. Immunosuppression for in vivo research: state-of-the-art protocols and experimental approaches. Cell Mol Immunol. 2017;14(2):146–79
- Le Blanc K, Samuelsson H, Gustafsson B, Remberger M, Sundberg B, Arvidson J, et al. Transplantation of mesenchymal stem cells to enhance engraftment of hematopoietic stem cells. Leukemia. 2007;21(8):1733–8
- Lee SH, Lee MW, Yoo KH, Kim DS, Son MH, Sung KW, et al. Cotransplantation of third-party umbilical cord blood-derived MSCs promotes engraftment in children undergoing unrelated umbilical cord blood transplantation. Bone Marrow Transplant. 2013;48(8):1040–5
- Bernardo ME, Ball LM, Cometa AM, Roelofs H, Zecca M, Avanzini MA, et al. Co-infusion of ex vivo-expanded, parental MSCs prevents life-threatening acute GVHD, but does not reduce the risk of graft failure in pediatric patients undergoing allogeneic umbilical cord blood transplantation. Bone Marrow Transplant. 2011;46(2):200–7
- Ball LM, Bernardo ME, Roelofs H, Lankester A, Cometa A, Egeler RM, et al. Cotransplantation of ex vivo expanded mesenchymal stem cells accelerates lymphocyte recovery and may reduce the risk of graft failure in haploidentical hematopoietic stem-cell transplantation. Blood. 2007;110(7): 2764–7
- Yue C, Ding Y, Gao Y, Li L, Pang Y, Liu Z, et al. Cotransplantation of haploidentical hematopoietic stem cells and allogeneic bone marrowderived mesenchymal stromal cells as a first-line treatment in very severe aplastic anemia patients with refractory infections. Eur J Haematol. 2018; 100(6):624–9
Artículos relacionados
- Inmunoterapia asociada a HLA
- El deporte y sus beneficios en el sistema inmunológico
- Influencia de los sistemas HLA y HNA en la susceptibilidad, protección inmunológica y éxito de tratamientos novedosos frente a COVID-19
- Moléculas HLA de clase II: HLA-DP
- Artritis reumatoide y HLA
- Exosomas tumorales: pequeñas vesículas, grandes vehículos
- Nueva nanoinmunoterapia para alcanzar la tolerancia en los trasplantes
- Técnicas moleculares para estudios de quimerismo post-trasplante médula ósea ¿Cuál elegir?