Índice de contenidos
DIVERSIDAD DEL SISTEMA KIR
La característica única del sistema KIR que lo distingue de otros tipos de receptores de células NK es su diversidad.
Una diversidad que es producto de tres factores: el contenido de genes KIR específico de cada individuo, el polimorfismo de secuencia de nucleótidos de cada gen KIR y la expresión estocástica y abigarrada de los repertorios de receptores KIR en clones individuales de células NK.
1. Diversidad en el contenido génico del sistema KIR
El número y tipo de los genes KIR varía sustancialmente entre haplotipos. El haplotipo más común en la mayoría de las poblaciones humanas es convencionalmente llamado el «haplotipo del grupo A» que lleva un contenido genético fijo que comprende KIR3DL3-2DL3-2DP1-2DL1-3DP1-2DL4-3DL1-2DS4-3DL2.
El resto de haplotipos KIR se conocen como «haplotipos del grupo B», y tienen un contenido genético variable que comprende varios genes que no son parte del haplotipo A.

Los homocigotos para los haplotipos del grupo A tienen solo siete genes KIR funcionales, mientras que los heterocigotos para los haplotipos del grupo A y del grupo B pueden tener los 14 genes KIR funcionales.
2. Polimorfismo de los genes KIR
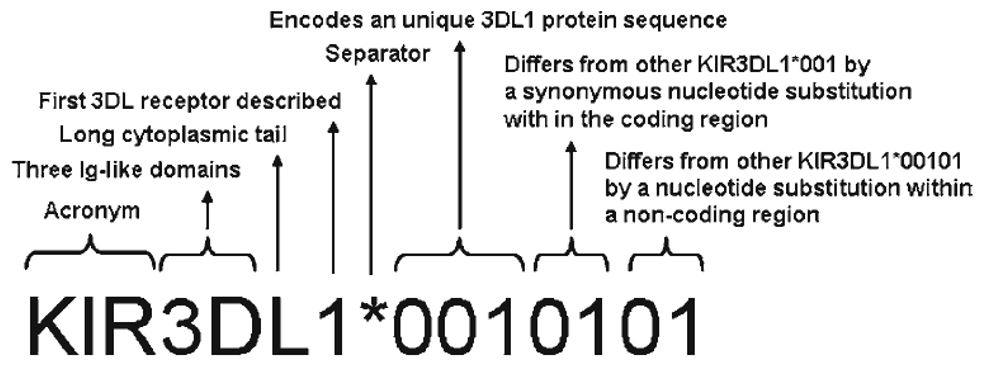
Además de la diversidad de contenido genético, cada gen KIR exhibe considerable polimorfismo en la secuencia nucleotídica. Las variantes de la secuencia alélica de los genes KIR se nombran de forma análoga a la utilizada para los alelos HLA. Después del nombre del gen, se utiliza un asterisco como separador antes de una designación numérica de alelo.
Los primeros tres dígitos indican alelos que difieren en las secuencias de sus proteínas codificadas. Los siguientes dos dígitos distinguen alelos que solo difieren por diferencias sinónimas (codifican la misma proteína). Los dos dígitos finales distinguen alelos que solo difieren por sustituciones en un intrón, promotor u otra región no codificante de la secuencia.
Los polimorfismos en la secuencia influyen en la expresión, la unión del ligando y en funciones citolíticas y de secreción de citoquinas. Como sucede en el HLA, algunas secuencias KIR son también alelos nulos.
3. Diversidad del repertorio de receptores KIR en los distintos clones de células NK
Además de la variación del contenido genético y el polimorfismo de secuencia, el nivel de expresión de ARNm varía entre los genes y alelos KIR. Además, existe splicing alternativo de ARNm y esta variedad de isoformas puede hacer que la expresión en la superficie de la célula se vea reducida.
Los receptores KIR se expresan clonalmente en células NK maduras de manera estocástica de forma que cada clon de células NK dentro de un determinado individuo no expresa el conjunto completo de genes KIR presentes en el genoma de ese individuo, sino solo una parte de los genes en una combinación aparentemente aleatoria.
Esta diversidad combinatoria de la expresión KIR produce una amplia gama de clones de células NK funcionalmente distintos que son críticos para una rápida detección de expresión reducida de HLA clase I en células objetivo. Cada clon de células NK mantiene su repertorio de receptores KIR adquiridos a lo largo de las divisiones celulares posteriores. Aunque el repertorio KIR está determinado en gran medida por factores genéticos, cada vez hay más pruebas de que los mecanismos epigenéticos modulan los patrones de expresión del receptor KIR.
A diferencia de las células T y B, las células NK utilizan una estrategia de reconocimiento de múltiples receptores mediante la cual se puede activar una célula NK individual a través de varios receptores independientemente o en combinación, dependiendo de los ligandos presentados por la célula objetivo en un determinado encuentro. Si una célula NK dada usa receptores inhibidores y activadores para reconocer el objetivo, el equilibrio entre estas señales dispares determina la acción de esa célula NK. Además de las células NK, los receptores KIR se expresan en un subconjunto de linfocitos T, en particular en células T γδ y células T de memoria efectoras CD8 +, indicando que los KIR pueden regular la respuesta inmune de células T específica de antígeno.
DIVERSIDAD DE KIR-HLA Y RELACIÓN CON ENFERMEDAD
A pesar de que la mayoría de las personas tienen los cuatro receptores KIR inhibidores (3DL1, 3DL2, 2DL1 y 2DL2 / 3), encontramos solo un subconjunto que expresa todos los ligandos HLA clase I relevantes: HLA-Bw4 (3DL1), HLA-A3 / 11 (3DL2), HLA-C2 (2DL1) y HLA-C1 (2DL2 / 3).
La mayoría de los caucásicos, hispanos y afroamericanos poseen dos o tres combinaciones inhibidoras de KIR-HLA. Curiosamente, uno de cada cinco individuos en estas poblaciones contiene un solo par receptor-ligando: KIR2DL3 + HLA-C1. Agentes ambientales como las infecciones virales que afecten a la expresión de HLA-C en individuos portadores de esta combinación única KIR-HLA pueden romper la auto tolerancia y favorecer la autoinmunidad.
La interacción entre KIR2DL3 y HLA-C1 es débil y las señales activadas por esta combinación de baja afinidad son superadas por señales activadoras, en contraste con las señales activadas a través de las interacciones inhibidoras más fuertes de KIR2DL1 + HLAC2. La variación de fuerza en las señales inhibidoras mediadas por KIR-HLA parece tener implicaciones clínicas. Individuos portando la combinación de genes KIR2DL3 + HLA-C1 poco inhibidora resuelve más fácilmente la infección con el virus de la hepatitis C que individuos infectados de otros genotipos.
Por otro lado, la interacción inhibitoria más fuerte de KIR2DL1 + HLA-C2 afecta al desarrollo placentario causando problemas reproductivos como preeclampsia, aborto espontáneo recurrente y restricción de crecimiento fetal.
Aunque la expresión en la superficie celular y los ligandos para los receptores KIR activadores no se ha definido claramente, hay indicios de asociación de distintos KIR activadores en inmunidad antiviral, enfermedades autoinmunes y cáncer. KIR2DS2 y 2DS1 están fuertemente asociados con la mayoría de las condiciones autoinmunes.
En contraste con las condiciones autoinmunes, la presencia del receptor activador KIR3DS1 ralentizó la progresión del SIDA en pacientes infectados por VIH-1, en comparación con pacientes que carecen de KIR3DS1, indicando así un posible efecto anti-VIH de KIR3DS1. También se demostró que el receptor KIR3DS1 es protector contra la infección por el virus de la hepatitis C (VHC).
En definitiva, los genotipos que codifican un repertorio KIR inhibidor dominante probablemente protegen contra la autoinmunidad pero son más susceptibles a infección y trastornos reproductivos, mientras que los genotipos que codifican un repertorio KIR dominante activador son presumiblemente más sensibles a la autoinmunidad y el cáncer, pero protegen de la infección viral.
Una mayor comprensión de la diversidad KIR-HLA y distinciones funcionales entre subpoblaciones de células NK son necesarias para aprovechar el poder de las células NK para fines terapéuticos.
CÉLULAS NK ALOREACTIVAS EN TRASPLANTE HEMATOPOYÉTICO HAPLOIDÉNTICO
El trasplante alogénico HLA compatible de células madre hematopoyéticas (HSCT) es un tratamiento efectivo para las neoplasias hematológicas, incluyendo leucemia, linfoma y enfermedades hematopoyéticas hereditarias.
Las células T del donante en el aloinjerto son críticas para promover la implantación del injerto y la erradicación de células malignas. Desafortunadamente, las células T aloreactivas también causan enfermedad de injerto contra huésped (GVHD), que es un ataque a los tejidos receptores, principalmente el tracto gastrointestinal, hígado y piel. La eliminación de las células T previene la GVHD pero aumenta el riesgo de rechazo del injerto y recaída leucémica.
Después de HSCT alogénico, las células de la médula donante repueblan todo el sistema hematopoyético del receptor. Las células NK son la primera población de linfocitos en aparecer en sangre periférica poco después de HSCT. Las células NK derivadas de donantes pueden ser aloreactivas si sus KIR inhibitorios no encuentran un ligando HLA de clase I que estuviera presente en el donante.
Estas células NK aloreactivas contribuyen en gran medida a muchos beneficios potenciales, incluidos la disminución de las tasas de GVHD, disminución de las tasas de rechazo del injerto gracias a la lisis de las células T del huésped por parte de las NK del donante, disminución de la recaída, mejora de la implantación del injerto mediado por liberación de citocinas por las células NK, y una mejor defensa inmune y disminución de complicaciones infecciosas mediadas por la actividad antiviral de células NK.
Esta aloreactividad beneficiosa de células NK, que puede predecirse a partir de diferencias en ligandos HLA de clase I de unión a KIR entre el donante y el receptor, se describió por primera vez para trasplante haploidéntico de HLA mediante el uso de un injerto al que se había desprovisto de células T.
Además, la ausencia en el receptor de ligandos HLA clase I para las células NK del donante y la expresión de receptores KIR en las células NK del donante influye en el resultado del HSCT. En comparación con los donantes con genotipos AA (expresan uno o ningún KIR activador) los donantes con genotipo Bx (expresan 1–6 KIR activadores) contribuyen a una protección contra recaídas significativamente superior y una mejor supervivencia libre de enfermedad para pacientes con leucemia mieloide.
Donantes emparentados con un haplotipo HLA idéntico y el otro haplotipo HLA completo no coincidente se consideran potencialmente capaces para aportar células NK aloreactivas contra el receptor cuando el tipaje de HLA-C y HLA-B muestra incompatibilidades del ligando KIR en la dirección injerto contra huésped (GvH), es decir, cuando el receptor no posee un alelo HLA-C (C1 o C2) y / o el grupo HLA-Bw4 que están presentes en el donante. Por otra parte, los donantes deben poseer el / los genes KIR para el reconocimiento de estos ligandos que no posee el receptor activándose así la aloreactividad por el mecanismo “missing-self”.
Se evalúa la compatibilidad HLA de los posibles donantes y del receptor mediante tipaje de los loci HLA-A, B, C, DR, DQ y DP. Aquellos receptores que expresan alelos de clase I pertenecientes a los tres grupos de clase I reconocido por los KIR (HLA-C grupo 1, HLA-C grupo 2 y alelos HLA-Bw4) bloquearán todas las células NK de cualquier donante (aproximadamente 1/3 de la población). Pacientes que expresan solo uno o dos de estos alelos pueden encontrar donantes con células NK aloreactivas. El tipaje HLA de la familia identificará a los miembros de la familia haploidénticos que expresan los grupos de clase I que faltan en el receptor y que, por lo tanto, tienen el potencial de ser un donante cuyas células NK ejercen aloreactividad contra el receptor.
En resumen, conociendo el genotipo KIR del donante, y los HLA tanto del donante como del receptor, es posible predecir el grado de interacciones KIR-HLA y eso puede dar opciones de limitar el GVHD y mejorar la implantación del injerto para ciertas leucemias.
Artículos relacionados
CÉLULAS NK Y RECEPTORES KIR (Parte I)
- AT1R y ETAR, receptores de angiotensina y endotelina
- Inmunoterapia asociada a HLA
- El deporte y sus beneficios en el sistema inmunológico
- Moléculas de histocompatibilidad no clásicas: MICA
- El sistema del complemento: la molécula C1q
- Influencia de los sistemas HLA y HNA en la susceptibilidad, protección inmunológica y éxito de tratamientos novedosos frente a COVID-19
- Crossmatch Virtual
- Moléculas HLA de clase II: HLA-DP