Índice de contenidos
Receptores acoplados a proteínas G (GPRCs)
Los receptores acoplados a proteínas G (GPCRs), son una superfamilia de proteínas que se encuentran en la membrana plasmática, también conocidos como receptores transmembrana de siete dominios, receptores 7TM, receptores tipo serpentina o receptores ligados a proteínas G. Su función es generar una respuesta celular frente a estímulos que se reciben a través de moléculas señalizadoras del exterior celular. Por ello, son de interés como dianas farmacológicas para diversas enfermedades.
Formación y localización de los GPRCs
Los GPRCs constituyen una superfamilia de hasta 800 especies moleculares en el ser humano, aunque mantienen características estructurales similares entre ellos. Están formados por una única cadena polipeptídica de entre 450 y 600 aminoácidos, con siete dominios transmembrana hidrofóbicos en forma de α-hélices que atraviesan la membrana. Estas regiones transmembrana se conectan entre sí por bucles hidrofílicos. El grupo N-terminal se sitúa en el exterior de la célula, mientras que el C-terminal se localiza en el espacio intracelular. Además, existe una región intracelular, que une el quinto y sexto segmento transmembrana y de longitud variable, que interacciona con las proteínas G.
Debido a su localización pueden reconocer fotones, iones, moléculas pequeñas (como hormonas, neurotransmisores, nucleótidos, etc.) péptidos y proteínas. Las respuestas celulares incluyen la regulación de diversas actividades enzimáticas, canales iónicos, transcripción génica, así como determinadas vías de supervivencia, motilidad y proliferación celular.
Existen dos vías principales de transducción de señales en las que estos receptores están involucrados: la vía del cAMP y la del fosfatidilinositol. De tal forma que la unión del ligando al receptor provoca un cambio conformacional en el receptor, permitiéndole actuar como un factor intercambiador de guanina. Así, el GPRC puede activar a la proteína G asociada intercambiando GDP pro GTP.
Receptores angiotensina II tipo I (AT1R) y endotelina A (ETAR)
Ambos receptores comparten la mayoría de las características de otros GPRCs (Edward Zhou et al., 2018), consistentes en un dominio extracelular N-terminal glicosilado seguido de regiones transmembrana que contienen siete hélices α hidrofóbicas.
Los dominios transmembrana están unidos mediante 3 bucles extracelulares e intracelulares más cortos. La estructura termina con un dominio C-terminal intracelular que contiene residuos de serina y treonina, que son dianas de fosforilación. Los subgrupos de los GPRCs se distinguen en base a la longitud de los dominios N- y C-terminales y unos pocos residuos de diferencia en los dominios transmembrana. La unión de moléculas como hormonas o anticuerpos a estos receptores causa un movimiento rotacional de estos complejos en la membrana de las células que promueve la interacción con subunidades de proteínas G (Unal et al., 2010). Como resultado de esta conexión a tres entre ligando (o autoanticuerpo), receptor y proteína G, la transducción de señal es rápida.
Tanto el receptor angiotensina II tipo 1 (AT1R) como el receptor tipo endotelina A (ETAR) están expresados ampliamente en el cuerpo humano (Abadir et al., 2012), incluyendo el endotelio vascular, las células del músculo liso, las células del sistema inmune, riñón, pulmón, corazón y tejidos placentarios (Sas et al., 2017; Dzau et al., 2001; Schulte et al., 2009).
AT1R es activado de manera natural por la unión de su ligando angiotensina II a residuos de los dominios transmembrana y al segundo bucle extracelular (Boucard et al., 2000) (Fig.1; Philogene et al., 2019), regulando importantes procesos como el flujo sanguíneo, la retención de sodio y la secreción de aldosterona. Además, juega un papel importante en la curación de heridas y reparación de daño tisular (Kurosaka et al., 2009).
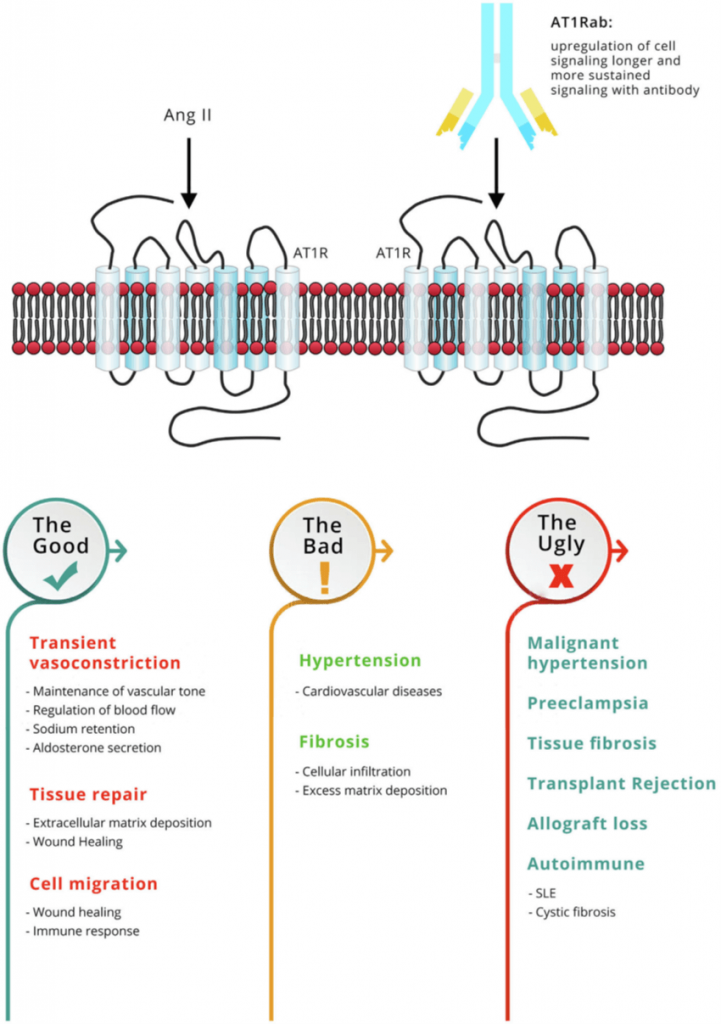
Figura 1. Funciones del receptor angiotensina II tipo 1.
La activación de ETAR por su ligando natural, endotelina 1, media funciones fisiológicas similares, pero, sobre todo, regula el flujo sanguíneo alternando vasoconstricción y vasodilatación, ya que endotelina 1 se une además de a ETAR a otros receptores de endotelina (Horinouchi et al., 2013).
Influencia de los niveles de AT1R y ETAR
Los niveles de AT1R y ETAR están influenciados por factores genéticos y ambientales. El aumento o descenso de la expresión de estos receptores puede provocar cambios en los patrones de activación que pueden afectar a la homeostasis celular.
Factores ambientales como la inflamación e infecciones o daño por isquemia también afectan a la expresión del receptor. Así, por ejemplo, un ambiente inflamatorio con concentraciones altas de IL-6 se asocia con un incremento de la expresión de AT1R en células endoteliales y estrés oxidativo (Wassmann et al., 2004), lo que puede causar disfunción endotelial. El aumento de expresión de A1TR y ETAR debido a diferencias genéticas o por resultado de estímulos ambientales puede generar más dianas a las que los autoanticuerpos pueden unirse. En definitiva, todos estos factores pueden contribuir al desarrollo de patologías autoinmunes que se observan cuando hay rechazo mediado por anticuerpos en pacientes que presentan anticuerpos circulantes frente a AT1R y ETAR (Fig. 1).
Anticuerpos anti-AT1R y anti-ETAR
El daño provocado por anticuerpos resultado de un trasplante de órgano suele ocurrir por el desarrollo de una respuesta inmune frente a antígenos no propios (Terasaki et al., 2012). Esta respuesta es debida, en su mayor parte, a la reactividad frente antígenos HLA por incompatibilidad entre donante y receptor, pero puede generar reactividad frente a otros aloantígenos expresados en el órgano trasplantado (Terasaki et al., 2003).
Del mismo modo, el daño mediado por anticuerpos puede ocurrir por una respuesta autoinmune frente a antígenos propios (Angaswamy et al., 2013).
Aunque se ha sugerido el papel de dianas antigénicas que no sean HLA para el éxito del trasplante, los avances en su caracterización, el entendimiento de su mecanismo de acción y el desarrollo de herramientas de diagnóstico para su detección todavía no son del todo satisfactorios.
Resultado de los receptores de AT1R y ETAR
Se han detectado anticuerpos frente a receptores acoplados a AT1R y ETAR en el suero de pacientes trasplantados que experimentaron disfunción en dicho órgano (Banasik et al., 2014). Anticuerpos frente a estos dos receptores fueron capaces de activar sus receptores diana, considerándose no sólo biomarcadores sino potenciales contribuidores al daño del injerto (Dragun et al., 2005; Wallukat et al., 2018). Sin embargo, las consecuencias pato-fisiológicas de la presencia de estos anticuerpos son todavía desconocidas.
Además de la disfunción del aloinjerto, los autoanticuerpos que activan GPRCs se han asociado a daño cardiovascular, preeclampsia, hipertensión, envejecimiento, enfermedades autoinmunes y cáncer (Wallukat et al., 2018; Wallukat el al., 2017; Becker et al., 2012; Budding et al., 2015; Günther et al., 2015; Aggarwal et al., 2017; Landsberger et al., 2014; Li et al., 2017).
Anticuerpos vs AT1R y ETAR
Los anticuerpos frente a AT1R y ETAR son “agonistas funcionales” porque ellos activan sus receptores diana de una forma similar a como lo hacen los ligandos endógenos, angiotensina II y endotelina I (Wallukat et al., 2018). Mientras que la activación por ligandos naturales es transitoria, la unión de los anticuerpos frente a AT1R y ETAR resulta en una activación más prolongada distorsionando la activación del receptor. La angiotensina II además de activar AT1R, activa un segundo receptor AT2R cuya señalización es relevante porque lleva a la vasodilatación y tiene efectos anti-inflamatorios y anti-fibróticos, modulando la vasoconstricción y los efectos pro-inflamatorios del AT1R (Wang et al., 2017).
Sin embargo, los anticuerpos frente a AT1R activan AT1R, pero no AT2R, aumentando la señalización vía AT1R. De forma similar, los anticuerpos frente a ETAR no activan un segundo receptor (receptor endotelina ETBR) lo que provoca también una distorsión de la activación.
Estos anticuerpos frente AT1R son IgG1 e IgG3 y frente a ETAR son IgG1, que son las subclases de inmunoglobulinas que unen el complemento con la mayor afinidad y, por ello, su presencia puede correlacionarse con depósitos de componentes del complemento en tejidos de pacientes trasplantados (O’Leary et al., 2017). La presencia de estos anticuerpos puede ser un precedente para el desarrollo posterior de anticuerpos anti-HLA y así, aumentar el riesgo de daño en el injerto mediado por anticuerpos (Cuevas et al., 2016).
Lo que se propone es que estos anticuerpos se desarrollan cuando hay daño en el endotelio del receptor o del órgano trasplantado. En pacientes con fallo del órgano trasplantado o con trasplante de órgano reciente, este daño endotelial ocurre en un ambiente pro-inflamatorio que conduce a un aumento de la fagocitosis y afectación de los receptores. Los antígenos propios pueden sufrir modificaciones post-traslacionales, creándose nuevos antígenos que son reconocidos como extraños, lo que genera una respuesta inmune (Darrah et al., 2017).
En ausencia de anticuerpos anti-HLA, la presencia de anticuerpos frente a AT1R y ETAR en biopsias con evidencia de daño mediado por anticuerpos, apoya su contribución al proceso del daño (Zhang et al., 2016).
Soluciones terapéuticas
Dado que los anticuerpos frente a AT1R y ETAR están asociados con efectos clínicos adversos, las dianas terapéuticas para combatir dichos efectos serían estos autoanticuerpos y sus receptores. Así, en pacientes que han recibido un trasplante de órgano, bloqueantes del receptor de la angiotensina son de especial interés ya que son bien tolerados y de uso común.
El tratamiento con plasmaféresis puede eliminar los autoanticuerpos circulantes (Yamada et al., 2018), pero no sólo reduce los niveles de autoanticuerpos en suero, sino que elimina citoquinas pro-inflamatorias, reduciendo el ambiente inflamatorio. Existen estudios donde la combinación de bloqueantes del receptor de la angiotensina con plasmaféresis en receptores de trasplante de riñón consigue reducir el riesgo de rechazo agudo (Carrol et al., 2016).
A pesar del peor pronóstico en cuanto al resultado de un trasplante en presencia de autoanticuerpos y anticuerpos anti-HLA (Giral et al., 2013), son muy pocos los centros de trasplantes que miden los niveles de anticuerpos frente a AT1R y ETAR en pacientes con disfunción del órgano trasplantado, una vez que los anticuerpos anti-HLA se han manifestado en el suero de los pacientes. Esta es la principal razón de la falta de datos que correlacionan la presencia de autoanticuerpos con rechazo crónico, algo que sería muy interesante para el diseño de protocolos de tratamiento.
Por tanto, la monitorización clínica en rutina de estos autoanticuerpos junto con estrategias terapéuticas adecuadas, pueden ayudar a prevenir daños a largo plazo y conducir a mejoras en la supervivencia del órgano trasplantado.
Bibliografía
- Edward Zhou X, Melcher K, Eric Xu H, Structural biology of G protein-coupled receptor signaling complexes, Protein Sci. (2018).
- Unal H, Jagannathan R, Bhat MB, Karnik SS, Ligand-specific conformation of extracellular loop-2 in the angiotensin II type 1 receptor, J. Biol. Chem 285 (21) (2010) 16341–16350.
- Abadir PM, Walston JD, Carey RM, Subcellular characteristics of functional intracellular renin-angiotensin systems, Peptides 38 (2) (2012) 437–445.
- Sas A, Banasik M, Dionizy P, et al., The expression of angiotensin II type 1 receptors (AT1R) in microcirculation of renal biopsy for cause might be significant, Transplant Int. 30 (2017) 245.
- Dzau VJ, Tissue angiotensin and pathobiology of vascular disease: a unifying hypothesis, Hypertension 37 (2001) 1047.
- Schulte S, Oidtmann A, Kociok N, et al., Hepatocyte expression of angiotensin II type 1 receptor is downregulated in advanced human liver fibrosis, Liver Int. 29 (3) (2009) 384–391.
- Boucard AA, Wilkes BC, Laporte SA, Escher E, Guillemette G, Leduc R, Photolabeling identifies position 172 of the human AT(1) receptor as a ligand contact point: receptor-bound angiotensin II adopts an extended structure, Biochemistry 39 (32) (2000) 9662–9670.
- Philogene MC, Johnson T, Vaught AJ, Zakaria S, Fedarko N. Antibodies against Angiotensin II Type 1 and Endothelin A Receptors: Relevance and pathogenicity. Hum Immunol. 2019;80(8):561-567.
- Kurosaka M, Suzuki T, Hosono K, et al., Reduced angiogenesis and delay in wound healing in angiotensin II type 1a receptor-deficient mice, Biomed. Pharmacother 63 (9) (2009) 627–634.
- Horinouchi T, Terada K, Higashi T, Miwa S, Endothelin receptor signaling: New insight into its regulatory mechanisms, J. Pharmacol. Sci 123 (2) (2013) 85–101.
- Wassmann S, Stumpf M, Strehlow K, et al., Interleukin-6 induces oxidative stress and endothelial dysfunction by overexpression of the angiotensin II type 1 receptor, Circ. Res 94 (4) (2004) 534–541.
- Terasaki PI, A personal perspective: 100-year history of the humoral theory of transplantation, Transplantation 93 (8) (2012) 751–756.
- Terasaki PI, Deduction of the fraction of immunologic and non-immunologic failure in cadaver donor transplants, Clin. Transpl (2003) 449–452.
- Angaswamy N, Tiriveedhi V, Sarma NJ, et al., Interplay between immune responses to HLA and non-HLA self-antigens in allograft rejection, Hum. Immunol 74 (11) (2013) 1478–1485.
- Banasik M, Boratynska M, Koscielska-Kasprzak K, et al., Non-HLA antibodies: angiotensin II type 1 receptor (anti-AT1R) and endothelin-1 type A receptor (anti-ETAR) are associated with renal allograft injury and graft loss, Transpl. Proc 46 (8) (2014) 2618–2621.
- Dragun D, Muller DN, Brasen JH, et al., Angiotensin II type 1-receptor activating antibodies in renal-allograft rejection, N. Engl. J. Med 352 (6) (2005) 558–569.
- Wallukat G, Pruss H, Muller J, Schimke I, Functional autoantibodies in patients with different forms of dementia, PLoS One 13 (3) (2018) e0192778.
- Wallukat G, Jandrig B, Kunze R, et al., Autoantibodies directed against the endothelin A receptor in patients with benign prostatic hyperplasia, Prostate 77 (5) (2017) 458–465.
- Becker M, Kill A, Undeutsch R, et al., Pathogenic effects of autoantibodies against vascular receptors in patients with SSc, Rheumatology (UK) 51 (2012) ii42–ii43.
- Budding K, van de Graaf EA, Hoefnagel T, et al., Anti-ETAR and anti-AT1R autoantibodies are elevated in patients with endstage cystic fibrosis, J. Cyst. Fibros 14 (1) (2015) 42–45.
- Günther J, Rademacher J, van Laar JM, Siegert E, Riemekasten G, Functional autoantibodies in systemic sclerosis, Semin. Immunopathol 37 (5) (2015) 529–542.
- Aggarwal S, Sunderland N, Thornton C, Xu B, Hennessy A, Makris A, A longitudinal analysis of angiotensin II type 1 receptor antibody and angiogenic markers in pregnancy, Am. J. Obstet. Gynecol 216 (2) (2017) 170.e1–170.e8.
- Landsberger M, Autoantibodies in type 2 diabetes patients with left ventricular dilatation: biomarkers and/or risk markers? Cardiology 129 (3) (2014) 189–190.
- Li Y, Tian J, Ma XR, et al., Increase in G protein-coupled receptor autoantibodies with decline of cardiac function in hypercholesterolemic rats, Eur. Rev. Med. Pharmacol. Sci 21 (5) (2017) 1065–1073.
- Wang Y, Del Borgo M, Lee HW, et al., Anti-fibrotic potential of AT2 receptor agonists, Front. Pharmacol 8 (2017) 564.
- O’Leary JG, Demetris AJ, Philippe A, et al., Non-HLA antibodies impact on C4d staining, stellate cell activation and fibrosis in liver allografts, Transplantation 101 (10) (2017) 2399–2409.
- Cuevas E, Arreola-Guerra JM, Hernandez-Mendez EA, et al., Pretransplant angiotensin II type 1-receptor antibodies are a risk factor for earlier detection of de novo HLA donor-specific antibodies, Nephrol. Dial. Transplant 31 (10) (2016) 1738–1745.
- Darrah E, Kim A, Zhang X, et al., Proteolysis by granzyme B enhances presentation of autoantigenic peptidylarginine deiminase 4 epitopes in rheumatoid arthritis, J. Proteome Res 16 (1) (2017) 355–365.
- Zhang Q, Reed EF, The importance of non-HLA antibodies in transplantation, Nat. Rev. Nephrol 12 (8) (2016) 484–495.
- Yamada C, Huang Y, Norman S, et al., Efficacy of therapeutic plasma exchange on angiotensin II type-1 receptor antibodies on two kidney transplant recipients, J Clin Apher. 33 (6) (2018) 673–677.
- Carroll RP, Riceman M, Hope CM, et al., Angiotensin II type-1 receptor antibody (AT1Rab) associated humoral rejection and the effect of peri operative plasma exchange and candesartan, Hum. Immunol 77 (12) (2016) 1154–1158.
- Giral M, Foucher Y, Dufay A, et al., Pretransplant sensitization against angiotensin II type 1 receptor is a risk factor for acute rejection and graft loss, Am. J. Transplant 13 (10) (2013) 2567–2576.

Detección de anticuerpos contra los receptores de la Angiotensina II tipo 1 (AT1R)
LABScreen Autoantibody
Artículos relacionados
- Inmunoterapia asociada a HLA
- El deporte y sus beneficios en el sistema inmunológico
- Moléculas de histocompatibilidad no clásicas: MICA
- El sistema del complemento: la molécula C1q
- Anticuerpos HLA en el trasplante hepático
- Moléculas HLA de clase II: HLA-DP
- Artritis reumatoide y HLA
- Farmacogenética: Herramienta clave para una Medicina de Precisión
- Farmacogenética, hacia una terapia personalizada