Índice de contenidos
Situación actual de la infección por HIV
El virus de la inmunodeficiencia humana (HIV) continúa siendo uno de los mayores problemas para la salud pública mundial, según datos de la Organización Mundial de la Salud (OMS). A día de hoy ya se ha cobrado más de 32 millones de vidas. Aunque no existe cura, el tratamiento con antirretrovirales eficaces permite mantenerlo controlado y prevenir la transmisión a otras personas.
El HIV ataca el sistema inmunitario y debilita los sistemas de defensa contra las infecciones y contra determinados tipos de cáncer. A medida que el virus destruye las células inmunitarias e impide su normal funcionamiento, la persona infectada va cayendo gradualmente en una situación de inmunodeficiencia.
El papel de los linfocitos T CD8+ (CTLs) en este proceso es crucial en el avance de esta infección. Su activación depende, entre otros factores, de la interacción de su receptor de antígenos (TCR) con un segmento proteico del virus presentado en el contexto del sistema del antígeno leucocitario humano de clase I (HLA-A, -B y -C).
Importancia de los CTLs en la infección por HIV
La disminución de la carga viral coincide con la expansión de LT CD8+ específicos. Una vez activados, los CTLs pueden ejercer su función efectora de dos formas: mediante la liberación de ciertas citoquinas que impiden la entrada del virus en la célula y/o su replicación o mediante su actividad citotóxica ejercida por exocitosis de gránulos que contienen perforina, granzima y otros mediadores, o por la apoptosis mediada por las interacciones Fas- FasL.
Participación del HLA-I en la patogénesis de la infección por HIV
Los genes codificados por las moléculas de HLA son los más polimórficos del genoma. Existe una correlación entre la expresión de ciertos antígenos del HLA y la progresión de la enfermedad.
En concreto, las moléculas de HLA-I se expresan en la superficie de todas las células nucleadas del organismo. Sin embargo, las moléculas codificadas por el HLA-I difieren en la capacidad para mediar el control de la replicación del virus, dependiendo del alelo que exprese el individuo y de la naturaleza del péptido que presenten.
La diversidad en la secuencia en moléculas de HLA-I varía desde micropolimorfismos (unos pocos aminoácidos) a diferencias en más de 30 aminoácidos. Los péptidos se unen a moléculas de HLA por interacciones entre las cadenas laterales de los residuos de anclaje del péptido y los bolsillos en las hendiduras de los sitios de unión a antígeno.
De los tres locus más relevantes de HLA-I se ha demostrado que el HLA-B (3000 alelos funcionales) tiene un papel dominante en la respuesta de los CTLs contra el HIV, comparado con los otros dos locus. Estas diferencias se pueden explicar parcialmente por el mayor polimorfismo que exhibe este alelo en la población (Pereyra et al., 2010), sumado al hecho de que las respuestas generadas son de mayor magnitud en comparación con las que ocurren en el contexto de HLA- A y C.
Por el contrario, la asociación de algunos alelos de moléculas HLA de clase II al HIV es aún objeto de debate por la falta de reproducibilidad de las asociaciones mostradas en diferentes grupos estudiados.
En infecciones virales, las moléculas HLA se han asociado con hipersensibilidad a determinados fármacos, la eliminación espontánea de la infección o también con un mejor pronóstico de la enfermedad en el caso de los controladores élite (Zaunders et al., 2013): pacientes que conviven con el HIV, pero que consiguen mantener unos niveles indetectables de carga viral sin necesidad de tomar terapia antirretroviral.
Por ejemplo, el síndrome de hipersensibilidad a abacavir (inhibidor de la transcriptasa inversa), una reacción de hipersensibilidad sistémica severa al antirretroviral abacavir se asocia con HLA-B*57:01, mientras que HLA-B*57:03, que contiene dos sustituciones de aminoácidos en la hendidura de unión antígeno no muestra ninguna asociación. HLA-B*58:01, que posee cuatro sustituciones en la hendidura de unión a antígeno, no muestra asociación con la hipersensibilidad a abacavir, pero sí muestra una fuerte asociación con hipersensibilidad a alopurinol (utilizado para eliminar el exceso de ácido úrico en plasma sanguíneo).
El papel de los alelos HLA-A en la infección parece menos importante que la de los alelos HLA-B. Sin embargo, diversos artículos indican que algunas variantes como HLA-A*03 y HLA-A*30 se asocian con una terapia antiviral efectiva, seleccionando posiciones de aminoácidos hidrofóbicos y conservados en proteínas virales como Nef y Gag.
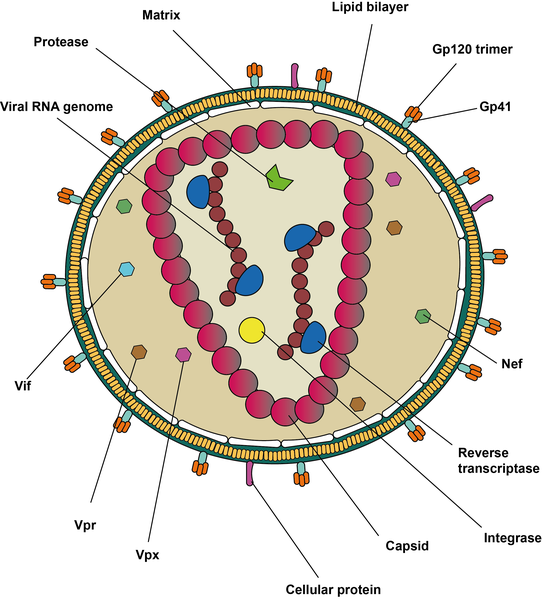
En el caso de HLA-C, debido a su reducida diversidad en la región de unión a péptido, parece más específico para la regulación de células NK, a diferencia de HLA-A y -B que están más dirigidos a la regulación de los CTLs. Aunque HLA-C sí parece influir en la expresión de HLA-B (Nunnari et al., 2016). En particular, HLA-B*35 suele estar asociado con HLA-C*04, lo que se relaciona con una progresión más rápida de la enfermedad.
Por su parte, los alelos HLA-B, entre ellos, HLA-B*08, -B*35 (Huang et al., 2009), -B*53, -B*55 y -B*56 se correlacionan con un peor pronóstico de la enfermedad, mientras que HLA-B*27 y -B*57 se asocian con un mejor pronóstico.
Uno de los factores que pueden contribuir al efecto protector del HLA-B*27 es el hecho de la presentación del epítopo conservado p24 Gag, que obliga al virus a invertir un mayor tiempo en escapar de la respuesta inmune, dando a su vez mayor tiempo al sistema inmune para eliminarlo.
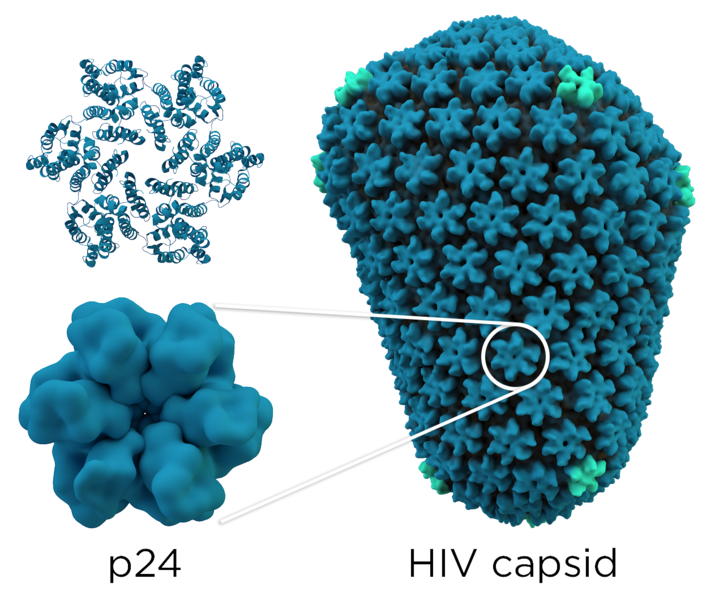
Asimismo, la familia de miembros HLA-B*57 se asocian con el fenotipo controladores élite. El efecto protector de HLA-B*57 parece deberse a una presentación de péptidos inmunogénicos de HIV más eficiente a los CTLs, que favorece un progreso de la enfermedad más lento (McLaren et al., 2015). De ellos, HLA-B*57:01 y HLA-B*57:03 son los más comunes en poblaciones caucásicas y africanas (Payne et al., 2014).
Por estas razones, se ha sugerido el papel protector de los linfocitos T HLA-B27/57 CD8+. Aunque hay que entender que se trata de un arma de doble filo ya que, por un lado, protege frente a infecciones virales y por otro, predispone a enfermedades autoinmunes.
Una explicación a este hecho se debe a la presencia de Tim-3 (T-cell immunoglobulin and mucin-domain containing-3), receptor inhibidor presente en una gran variedad de células inmunes y que interacciona con galectina 9 (Gal-9). Gal-9 se expresa de forma constitutiva en linfocitos T reguladores (Tregs), que inhiben la respuesta de los CTLs. Pero, los linfocitos T HLA-B27/57 CD8+ son capaces de evadir la respuesta de los Tregs a través de granzima B. Esto es debido a que estos linfocitos muestran sobreexpresión de esta granzima y, por el contrario, niveles bajos de Tim-3 lo que impide la interacción con Gal-9 y bloquea la acción de los Tregs (Elahi et al., 2011).
Por tanto, cuando se diseñen vacunas o fármacos para el HIV desde una perspectiva epidemiológica, hay que considerar la variabilidad genética asociada a los alelos HLA y cómo puede afectar este hecho a la evasión viral del sistema inmune y al progreso de la enfermedad.